ОСНОВНАЯ ИНФОРМАЦИЯ О ЖУРНАЛЕ
«Безопасность и риск фармакотерапии» – научно-практический рецензируемый журнал открытого доступа, выпускаемый в печатной и онлайн-версиях, единственный в России, полностью посвященный данной тематике. Основан в 1999 году.
Цель журнала: освещение научных достижений и практического опыта в области обеспечения безопасности лекарственных средств и снижения рисков фармакотерапии.
Целевая аудитория. Предназначен для специалистов практического здравоохранения, клинических фармакологов и врачей других специальностей, провизоров, специалистов экспертных учреждений, уполномоченных по фармаконадзору и специалистов по фармаконадзору фармацевтических компаний и организаций, сотрудников центров доклинических и клинических исследований, регуляторных и контрольно-надзорных органов в сфере обращения лекарственных средств, научно-исследовательских институтов, преподавателей, студентов и соискателей медицинских и фармацевтических вузов. Более подробная информация – в разделе «Цели и тематика».
Учредитель: ФГБУ «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации.
Периодичность: 4 раза в год.
Импакт-фактор: двухлетний импакт-фактор РИНЦ (2024) - 0,826.
Редколлегия. Географическое представительство:
- 3 континента
- 10 стран
- 17 городов
Рецензирование:
- Двойное слепое
- Минимум 2 рецензента на рукопись
Основные метрики журнала:
- 14 дней в среднем от подачи до первого решения
- 151 день в среднем от подачи до публикации в Интернете
- 23% приглашенных авторов
- 63% доля принятия рукописей
- 37 тыс. загрузок PDF в 2023 г.
Плата за публикацию: бесплатно.
Индексация. Входит в Scopus (Accepted Titles May 2025), Перечень ВАК (категория К1), Russian Science Citation Index, РИНЦ, DOAJ seal. Информация об индексации в других российских и международных базах доступна в разделе Индексирование.
Регистрация. Свидетельство о регистрации средства массовой информации ПИ № ФС77-82932 от 14 марта 2022 г.
Подписка. Подписной индекс в каталоге Пресса России – 57940, Урал-Пресс – 57940.
Текущий выпуск
ГЛАВНАЯ ТЕМА: БЕЗОПАСНОСТЬ ПАЦИЕНТА: КАК ДОКЛИНИЧЕСКИЕ ДАННЫЕ И ПОСТРЕГИСТРАЦИОННЫЙ ФАРМАКОНАДЗОР ФОРМИРУЮТ СОВРЕМЕННЫЙ ЛАНДШАФТ ФАРМАКОТЕРАПИИ
ВВЕДЕНИЕ. Необходимым условием для создания эффективных и безопасных радиофармацевтических лекарственных препаратов (РФЛП) является наличие юридически, организационно и научно обоснованной регуляторной системы их обращения. В связи с отсутствием как национального российского, так и действующего в Евразийском экономическом союзе (ЕАЭС) руководства по доклинической разработке РФЛП были рассмотрены международные подходы к объему доклинических исследований (ДКИ) и экспертному рассмотрению полученных результатов.
ЦЕЛЬ. Актуализация экспертных подходов к оценке результатов ДКИ современных РФЛП на основе анализа научно-методических рекомендаций, регуляторных требований и экспертного опыта в Российской Федерации и за рубежом.
ОБСУЖДЕНИЕ. Практически во всем мире РФЛП рассматриваются как лекарственные средства. Для ввода в обращение оригинального препарата необходима реализация полного цикла разработки, включая оценку специфической активности, токсических свойств, фармакокинетических и фармакодинамических параметров. К ДКИ РФЛП применимы общие принципы доклинической разработки, изложенные в соответствующих руководствах ЕАЭС с обязательным учетом особого свойства таких препаратов — радиоактивности. Специфическими ДКИ таргетных РФЛП являются: определение мишени фармакологического действия; выбор и разработка таргетирующих векторов для доставки радионуклида; выбор хелаторов для присоединения радионуклидов к векторам; выбор радионуклида; оценка специфичности связывания и активности in vitro; оценка цитотоксичности; выбор релевантной модели in vivo для оценки биораспределения и терапевтической эффективности или визуализации; дозиметрия; токсикологические исследования; подготовка к трансляции в клинические исследования. Общий формат отчета Европейского союза по оценке результатов ДКИ РФЛП в целом соответствует форме экспертного отчета по оценке результатов доклинических (неклинических) исследований ЕАЭС.
ВЫВОДЫ. Подходы к проведению ДКИ РФЛП и экспертной оценке их результатов в ЕАЭС и Европейском союзе имеют принципиальное сходство. Существует возможность формирования базовых регуляторных и экспертных требований и общих рекомендаций по доклинической разработке РФЛП. Наряду с разработкой общих методических рекомендаций целесообразно составление приложений по отдельным группам РФЛП на основе актуальных научных данных и регуляторного опыта в Российской Федерации и за рубежом.
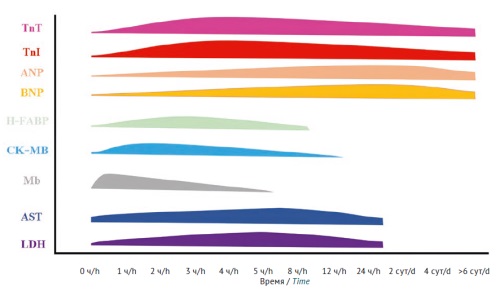
ВВЕДЕНИЕ. Оценка безопасности лекарственных средств в отношении сердечно-сосудистой системы с использованием моделей in vivo является необходимым этапом доклинических исследований, которая проводится либо в исследованиях фармакологической безопасности, либо в рамках токсикологических исследований. В дизайне исследований фармакологической безопасности в первую очередь подразумевается оценка потенциала исследуемого вещества замедлять реполяризацию желудочков сердца без углубленного изучения возможного структурного повреждения сердца и сосудов. При этом в токсикологических исследованиях, как правило, не оцениваются электрофизиологические параметры. В нормативной документации Евразийского экономического союза и Международного совета по гармонизации (ICH) отсутствуют подробные указания по использованию специфических маркеров нарушений функционирования сердечно-сосудистой системы.
ЦЕЛЬ. Разработка комплексного подхода по оценке кардио- и васкулотоксичности лекарственных препаратов в доклинических исследованиях in vivo.
ОБСУЖДЕНИЕ. Для оценки функционального состояния сердечно-сосудистой системы могут быть использованы как мелкие лабораторные животные (грызуны), так и более крупные, такие как кролики, хорьки, собаки, карликовые свиньи и приматы. Токсические эффекты изучаемых лекарственных препаратов в отношении сердца и сосудов у животных могут проявляться в виде изменений в физиологическом, биохимическом или структурном статусах систем или органов, поэтому оценка функционального состояния сердечно-сосудистой системы должна опираться на совокупность инструментальных, лабораторных и гистологических методов. В первую очередь применимы физиологические и лабораторные исследования. Рекомендовано проводить электрокардиографию, измерение частоты сердечных сокращений и артериального давления, а также количественно оценивать маркеры нарушения функций и структурного повреждения клеток. Для более глубокого анализа рекомендуется применять гистологические и иммуногистохимические исследования тканей сердца и сосудов, чтобы оценить изменения на тканевом и клеточном уровнях.
ВЫВОДЫ. Эффективным способом обнаружения нарушений сердечно-сосудистой системы является применение комплексного подхода, который, с одной стороны, позволяет всесторонне оценить возможные токсические проявления лекарственного средства, а с другой — увеличивает трансляционной потенциал данных, получаемых на доклиническом этапе исследований.
ВВЕДЕНИЕ. Потенциальная гепатотоксичность изониазида является ведущей причиной его отмены, что значительно уменьшает эффективность противотуберкулезной терапии, повышает риск рецидива заболевания и вызывает вторичную лекарственную устойчивость Mycobacterium tuberculosis. Развитие гепатотоксических реакций при применении изониазида связано с генетическими особенностями активности изофермента N-ацетилтрансферазы-2 (NAT2), участвующего в биотрансформации препарата в печени. Снижение дозы изониазида у пациентов с медленным типом ацетилирования позволяет предотвратить поражение печени, но единый алгоритм дозирования этого противотуберкулезного средства в зависимости от результатов фармакогенетического тестирования отсутствует.
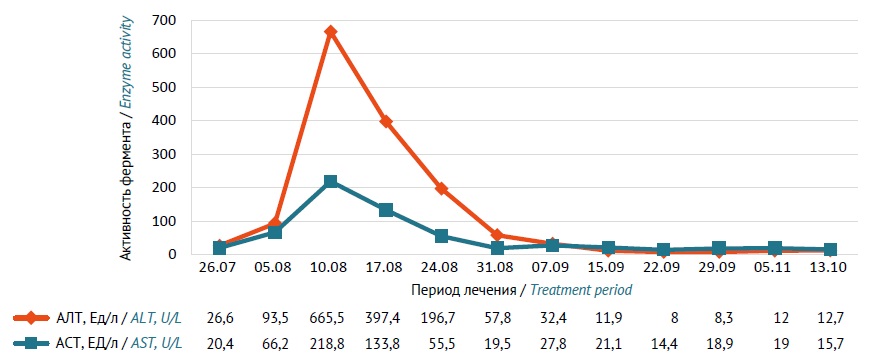
ОПИСАНИЕ СЛУЧАЯ. Мужчина 35 лет, якут, с диагнозом «А16.0 Очаговый туберкулез S1–2 обоих легких в фазе инфильтрации без выделения микобактерий туберкулеза» в 2022 г. проходил лечение в отделении туберкулеза органов дыхания ГБУ Республики Саха (Якутия) «НПЦ «Фтизиатрия» им. Е.Н. Андреева». Диагноз установлен на основании клинико-лабораторных и инструментальных исследований. Назначена внутрь 1 раз/сут комбинация противотуберкулезных средств: изониазид — 500 мг, рифампицин — 600 мг, пиразинамид — 1750 мг и этамбутол — 1200 мг. В интенсивной фазе терапии туберкулеза легких у пациента появились симптомы токсического поражения печени гепатоцеллюлярного типа умеренной степени тяжести: тошнота, однократная рвота, слабость, боль в эпигастральной области. Активность аланиновой трансаминазы в сыворотке крови повышена до 665,5 Ед/л, аспарагиновой трансаминазы — до 218,8 Ед/л. При ультразвуковом исследовании диагностированы умеренная гепатомегалия, диффузные изменения паренхимы печени, селезенки, хронический холецистит, реактивный панкреатит. По результатам фармакогенетического тестирования установлено, что пациент является носителем аллельных вариантов гена NAT2: *5, *11, *12, ассоциированных с медленным типом ацетилирования изониазида. Противотуберкулезные средства были временно отменены, назначена гепатопротективная терапия. При продолжении лечения доза изониазида была снижена до 300 мг/сут, остальные препараты пациент принимал в прежней дозе. Переносимость противотуберкулезной терапии была удовлетворительной, гепатотоксические реакции не развивались. Интенсивная фаза лечения туберкулеза составила 64 сут. По результатам положительной клинико-рентгенологической динамики пациент выписан из стационара. Терапия в фазе продолжения включала комбинацию изониазида в дозе 300 мг и рифампицина в дозе 600 мг 1 раз/сут в течение 120 сут. После завершения терапии было констатировано клиническое излечение, пациент переведен в III группу диспансерного наблюдения.
ВЫВОДЫ. Индивидуализация дозы изониазида по результатам фармакогенетического тестирования позволила продолжить лечение пациента лекарственно-чувствительным туберкулезом легких и избежать повторного развития изониазид-индуцированного поражения печени.
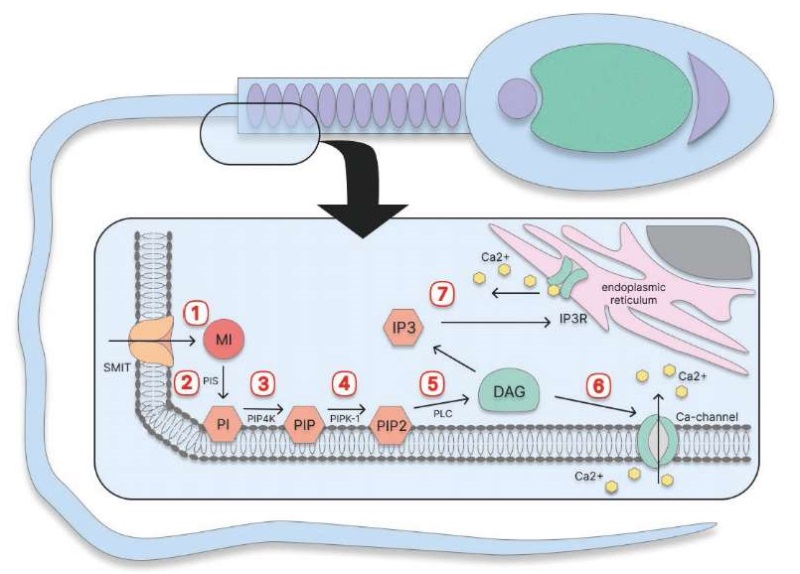
ВВЕДЕНИЕ. Мужское бесплодие, в частности недостаточность мужской репродуктивной функции, часто связано с окислительным стрессом. Мио-инозитол, обладающий антиоксидантными свойствами, играет важную роль в различных биохимических и клеточных процессах, происходящих в сперматозоидах, в том числе положительно влияет на функцию митохондрий и подвижность сперматозоидов. Это создает предпосылки для его применения в комплексном лечении недостаточности мужской репродуктивной функции различного генеза, включая олигоастенотератозооспермию, астенозооспермию, а также при вспомогательных репродуктивных технологиях.
ЦЕЛЬ. Оценка возможности и эффективности применения инозитола для восстановления сперматогенеза у мужчин при нарушениях репродуктивной функции, вызванных окислительным стрессом.
ОБСУЖДЕНИЕ. Окислительный стресс вызывает нарушение клеточной мембраны сперматозоидов, дисфункцию митохондрий и повреждение ДНК. Показано, что мио-инозитол оказывает положительное воздействие на сперматогенез за счет антиоксидантных свойств и активизации митохондриального метаболизма. Он способствует увеличению производства АТФ, снижает уровень маркеров окислительного повреждения, уменьшает фрагментацию ДНК и улучшает морфологию сперматозоидов. Мио-инозитол также повышает уровень тестостерона в клетках, увеличивает подвижность сперматозоидов за счет оптимизации взаимодействия актин–глобулин и модулирует содержание внутриклеточного кальция, необходимого для окислительного метаболизма и синтеза АТФ. По данным клинических исследований, мио-инозитол увеличивает общую подвижность сперматозоидов на 20–30%, долю прогрессивно-подвижных сперматозоидов до 40%, повышает частоту оплодотворений на 10–15% и снижает фрагментацию ДНК на 3–5%. Применение мио-инозитола при криоконсервации спермы уменьшает уровень активных форм кислорода, апоптоз, фрагментацию ДНК сперматозоидов, поддерживает митохондриальный мембранный потенциал и повышает эффективность окислительного фосфорилирования.
ВЫВОДЫ. Мио-инозитол является перспективным соединением для терапии недостаточности мужской репродуктивной функции, включая олигоастенотератозооспермию, астенозооспермию, а также для подготовки спермы к использованию при вспомогательных репродуктивных технологиях. Благодаря антиоксидантным свойствам мио-инозитол может быть рекомендован в случае, когда предполагается или лабораторно подтверждается окислительное повреждение спермы. Однако для подтверждения положительного влияния мио-инозитола на репродуктивную функцию у мужчин необходимы дальнейшие масштабные контролируемые исследования.
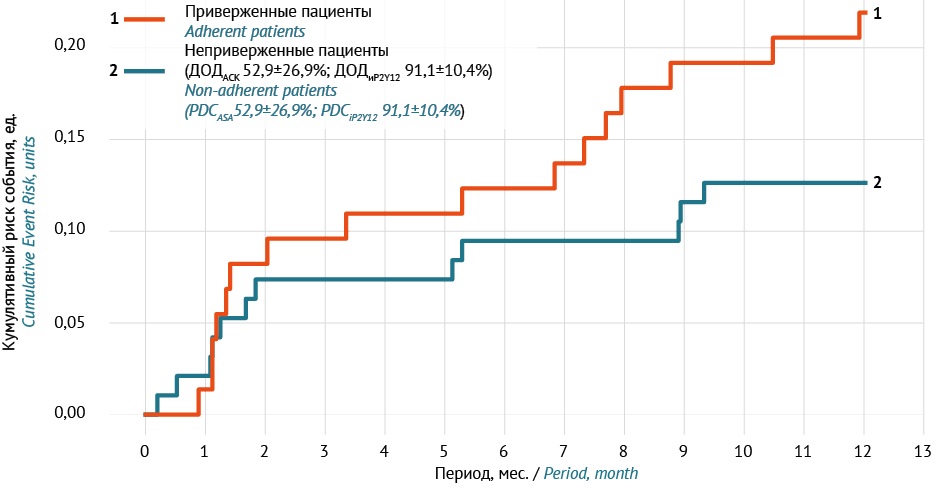
ВВЕДЕНИЕ. Реальную эффективность и безопасность двойной антитромбоцитарной терапии (ДАТТ) целесообразно оценивать, если есть уверенность, что пациенты выполняют предписания врачей. Для поиска причин неприверженности ДАТТ необходим совокупный анализ развития нежелательных реакций (НР), их врачебной коррекции и развития клинически значимых ишемических событий у пациентов после острого инфаркта миокарда (ОИМ).
ЦЕЛЬ. Провести анализ частоты и тяжести геморрагических реакций в зависимости от приверженности пациентов двойной антитромбоцитарной терапии на основании данных Единой медицинской информационно-аналитической системы (ЕМИАС) за 2021–2023 гг. (г. Москва) для оценки влияния на клинические исходы.
МАТЕРИАЛЫ И МЕТОДЫ. Проведен ретроспективный анализ данных ЕМИАС о пациентах, находившихся под диспансерным наблюдением кардиологов московской поликлиники в течение 1 года после ОИМ. Для регистрации НР использовали рекомендованный ВОЗ метод, основанный на учете всех медицинских записей о пациенте. Приверженность ДАТТ оценивали методом учета реализованных электронных рецептов. В анализ включены 168 пациентов, приверженных ДАТТ в первые 6 месяцев терапии.
РЕЗУЛЬТАТЫ. При выписке из стационара пациенты получали ацетилсалициловую кислоту в дозе 100 мг (97,6%) в комбинации с ингибитором Р2Y12-рецепторов тромбоцитов, преимущественно тикагрелором (76,2%). Комплексную приверженность ДАТТ во втором полугодии утратили 73 (44,5%) человека (неприверженные). Геморрагии любой степени тяжести в течение года зарегистрированы у 24,4% пациентов (общее число НР — 57); в первом полугодии — у 15,5%. Во втором полугодии степень тяжести кровотечений по шкале BARC была выше среди сохранивших приверженность пациентов по сравнению с неприверженными (p=0,035). Коррекция ДАТТ кардиологами осуществлялась у 29,3% пациентов с кровотечениями, чаще в первом полугодии (22% против 7,3% во втором; р=0,029). Число госпитализаций по кардиальным причинам во втором полугодии было выше у неприверженных пациентов (р=0,047), которые преимущественно отказывались от приема ацетилсалициловой кислоты (доля обеспеченных дней 52,9±26,9%) в среднем на протяжении 111,7±37,7 сут («обрыв» терапии).
ВЫВОДЫ. Только 56,5% пациентов после ОИМ сохранили приверженность ДАТТ во втором полугодии. Частота геморрагических НР за год составила 24,4%. Данные НР были тяжелее у приверженных (p=0,035), однако госпитализации по кардиальным причинам преобладали у неприверженных пациентов (p=0,047). Необходим мониторинг баланса риска кровотечений и тромботических событий при длительной ДАТТ; целесообразна персонализация подхода в клинической практике: стратификация риска кровотечений с использованием шкал PRECISE-DAPT/BARC, для пациентов с высоким риском — ранний переход на монотерапию (например, клопидогрел после 3–6 мес.) с акцентом на баланс между антиишемической эффективностью и геморрагическим риском.
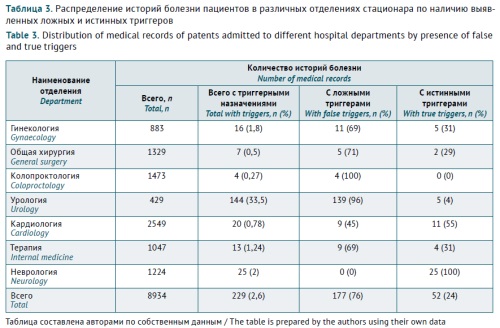
ВВЕДЕНИЕ. Лекарственно-индуцированные аллергические реакции (ЛИАР) у госпитализированных пациентов ограничивают возможности рациональной фармакотерапии и увеличивают риск полипрагмазии в связи с необходимостью коррекции состояния пациента и назначения противоаллергических препаратов. Объективная оценка частоты ЛИАР в стационаре и структуры препаратов для коррекции назначений является актуальной задачей, решение которой позволит как достичь значимого улучшения клинических исходов пациентов, так и снизить бремя затрат системы здравоохранения. Метод глобальных триггеров основан на анализе медицинской документации и фиксировании определенных триггеров, что делает его легко применимым в клинической практике.
ЦЕЛЬ. Изучение возможности использования метода глобальных триггеров для оценки распространенности ЛИАР у пациентов многопрофильного стационара.
МАТЕРИАЛЫ И МЕТОДЫ. Ретроспективное фармакоэпидемиологическое исследование медицинской документации пациентов, госпитализированных в ГБУЗ «Городская клиническая больница № 24 Департамента здравоохранения города Москвы» в период с 01.10.2022 по 01.04.2023, с использованием метода глобальных триггеров. Критерии включения: пациенты, проходившие стационарное лечение в отделениях терапевтического и хирургического профиля в указанный период. Критерии исключения: пациенты отделения аллергологии.
РЕЗУЛЬТАТЫ. Всего за анализируемый период в отделения терапевтического и хирургического профилей поступили 8934 пациента. Триггеры ЛИАР были идентифицированы у 229 (2,6%, то есть 2563 на 100 000 пациентов). Оценка листов назначений, дневников и клинико-лабораторных данных позволила выявить лишь 52 истинных триггера ЛИАР (22,7%). В оставшихся 177 случаях (77,3%) противоаллергический препарат был назначен до или одномоментно с подозреваемым лекарственным средством, предположительно с целью профилактики возможного развития аллергической реакции, что оценивали как ложный триггер. Основными группами подозреваемых препаратов явились антибактериальные средства для системного применения (22 препарата (40,7%), в частности бета-лактамные антибиотики — 14 препаратов (20,3%)), а также моноклональные антитела (21 препарат (38,9%)).
ВЫВОДЫ. Истинная частота развития ЛИАР составила 0,58% (582 на 100 000 пациентов). Продемонстрированные в исследовании результаты показали эффективность применения метода глобальных триггеров для выявления случаев лекарственной аллергии в реальной клинической практике. Исключение ложных триггеров (прежде всего профилактических назначений лекарственных препаратов) уменьшает искажение реальной частоты ЛИАР и гипердиагностики данного состояния.
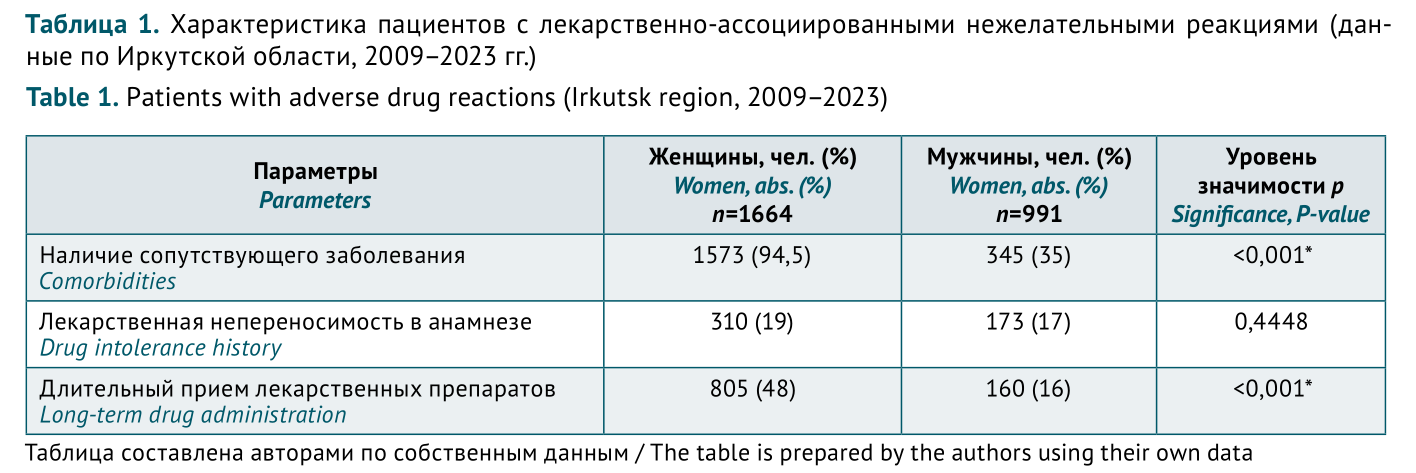
ВВЕДЕНИЕ. С 01.03.2025 в соответствии с приказом Росздравнадзора от 17.06.2024 № 3518 вступил в силу обновленный Порядок фармаконадзора лекарственных препаратов (ЛП) для медицинского применения. Анализ опыта передачи в Росздравнадзор сообщений о нежелательных реакциях (НР) является одним из методов, позволяющих адаптировать систему фармаконадзора медицинской организации к новым требованиям.
ЦЕЛЬ. Оценка полноты и корректности передачи в Росздравнадзор информации о случаях развития НР при применении ЛП для подготовки рекомендаций по заполнению формы «Извещения о нежелательной реакции или отсутствии терапевтического эффекта лекарственного препарата».
МАТЕРИАЛЫ И МЕТОДЫ. Проведен ретроспективный анализ базы данных карт-извещений о НР ЛП, сформированной на основе регистра Регионального центра мониторинга безопасности лекарственных средств Иркутской области (2009–2019 гг.) и региональных данных Автоматизированной информационной системы Росздравнадзора (2019–2023 гг.). Оценку степени достоверности причинно-следственной связи «НР–ЛП» проводили по шкале Наранжо.
РЕЗУЛЬТАТЫ. В указанный период из медицинских организаций Иркутской области поступило 2655 спонтанных сообщений. Установлено, что сроки репортирования данных соблюдались в 91,3% случаев. Данные, полностью характеризующие НР, ЛП и пациента, были представлены в 87,1% карт-извещений. Информация о наличии у пациентов фоновых заболеваний присутствовала в 72,3% случаев. Наиболее частым недостатком (3,1%) было частичное отсутствие информации о пациенте (вес, наличие аллергических реакций, результаты лабораторных исследований). Доля случаев терапевтической неэффективности составила 2,0%. В 21,5% случаев выявлено неправильное применение ЛП, в основном — назначение антибактериальных ЛП при вирусных инфекциях. Наличие причинно-следственной связи (ПСС) развития НР с применением ЛП было подтверждено в большинстве случаев (94,5%), степень достоверности ПСС оценена как определенная (25,0% случаев), вероятная (23,2%), возможная (48,3%), сомнительная (3,5%).
ВЫВОДЫ. Проведенный анализ показал, что в основном сведения о НР были переданы из медицинских организаций с соблюдением сроков и объема информации, предусмотренных требованиями соответствующих нормативных документов. Сроки отправки сообщений о серьезных НР с летальным исходом или угрозой для жизни были соблюдены во всех случаях. Для корректной оценки степени достоверности ПСС «ЛП–НР» в карту-извещение целесообразно включать максимально возможный объем данных о пациенте, НР и ЛП. Постоянное информирование врачей о порядке осуществления фармаконадзора и сроках передачи данных о НР в Росздравнадзор будет способствовать обеспечению эффективной работы системы фармаконадзора медицинской организации.
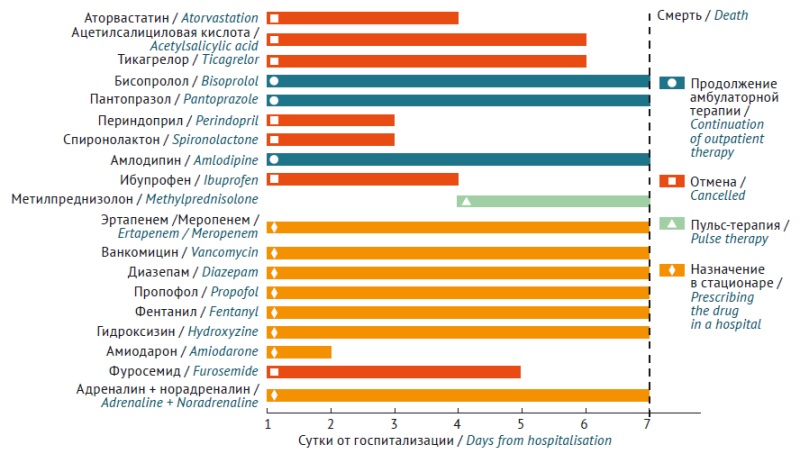
ВВЕДЕНИЕ. Пациенты после острого коронарного синдрома находятся в группе высокого риска повторных сердечно-сосудистых катастроф, для предотвращения которых в рамках клинических рекомендаций они получают интенсивную липидоснижающую и дезагрегантную терапию. Однако интенсификация терапии сопряжена с повышенным риском развития нежелательных реакций (НР). В представленном клиническом случае приведено описание фатального рабдомиолиза, ассоциированного с высокодозной терапией розувастатином. Проанализированы факторы риска этой НР, знание которых может помочь предотвратить аналогичные события у пациентов.
ОПИСАНИЕ СЛУЧАЯ. Пациент 68 лет, мужчина, находился на постоянной терапии розувастатином 10 мг/сут в течение 3-х лет с удовлетворительной переносимостью. После развития острого коронарного синдрома доза розувастатина была увеличена до максимальной (40 мг/сут), назначена двойная дезагрегантная терапия тикагрелором и ацетилсалициловой кислотой, а также бисопролол, амлодипин, омепразол, периндоприл, спиронолактон. В течение месяца у пациента развились мышечные боли, острая почечная недостаточность с клинико-лабораторной картиной, подтверждающей рабдомиолиз. Несмотря на интенсивную терапию, через 8 сут пациент скончался. Был проведен анализ на генетические маркеры индивидуальных особенностей фармакокинетики розувастатина со следующими результатами: CYP2C9 *1*1 (нормальная активность), SLCO1B1 *5*15 (сниженная активность в гомозиготном состоянии), ABCG2 c.421 C/C (нормальная активность). Анализ лекарственных взаимодействий по данным литературы выявил вероятность дополнительного повышения концентрации розувастатина (до 2,6 раза) на фоне угнетения тикагрелором активности транспортера BCRP (белка резистентности рака молочной железы).
ВЫВОДЫ. В описанном случае фатальный статин-ассоциированный рабдомиолиз развился на фоне двух значимых факторов: генетической предрасположенности и значимого межлекарственного взаимодействия розувастатина с тикагрелором, что привело к нарушению работы сразу двух белков-переносчиков: BCRP, определяющего биодоступность препарата, и OATPB1, осуществляющего его транспорт через мембрану гепатоцита. При ведении пациентов, которым показана высокодозная терапия статинами и другими препаратами, обладающими потенциалом значимых лекарственных взаимодействий, следует осуществлять фармакогенетическое тестирование, а также активный мониторинг лабораторных показателей в первые дни после назначения лекарственной терапии для своевременной диагностики возможных осложнений.
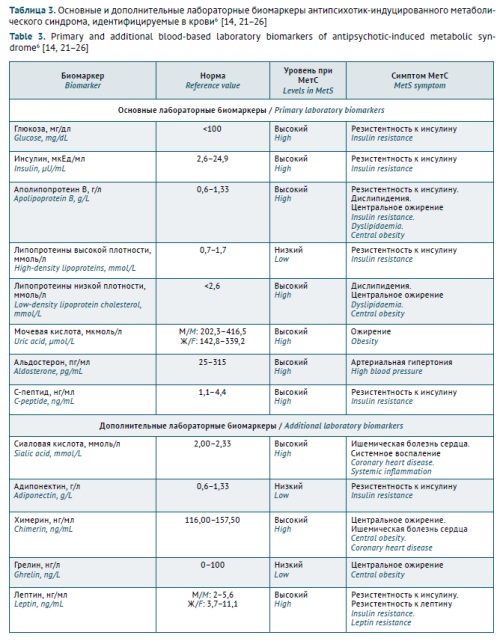
ВВЕДЕНИЕ. Антипсихотик-индуцированный метаболический синдром (АИМетС) является распространенной нежелательной реакцией при фармакотерапии психических расстройств и болезней зависимости. Однако чувствительность и специфичность известных биохимических биомаркеров в крови могут быть недостаточными для оценки безопасности психофармакотерапии и риска развития АИМетС в связи с индивидуальными различиями метаболизма антипсихотиков у пациентов c расстройствами шизофренического спектра. Циркулирующие микроРНК в крови рассматриваются как новые перспективные эпигенетические биомаркеры АИМетС.
ЦЕЛЬ. Оценить возможность использования циркулирующих микроРНК как эпигенетических биомаркеров для прогнозирования и ранней диагностики АИМетС.
ОБСУЖДЕНИЕ. Проведен анализ результатов фундаментальных и клинических исследований роли циркулирующих микроРНК, влияющих на основные звенья патогенеза и прогрессирования АИМетС, опубликованных в период 2012–2024 гг. Представлены новые международные подходы к использованию основных и дополнительных клинических и биохимических биомаркеров АИМетС, показаны преимущества использования микроРНК в качестве эпигенетических биомаркеров АИМетС. Приведены обобщенные данные о роли микроРНК в механизмах развития АИМетС, включая окислительный стресс, системное воспаление, дифференцировку адипоцитов, метаболизм липидов и глюкозы, регуляцию аппетита, изменение экспрессии нейропептида Y, чувствительности к лептину, экспрессии орексина, уровней тестостерона, тиреоидных гормонов и паратиреоидного гормона.
ВЫВОДЫ. Выявление изменений уровня экспрессии циркулирующих микроРНК в доступных образцах (кровь, слюна, моча) перспективно как одна из альтернативных методологий прогнозирования и диагностики АИМетС. Во второй части обзора будет рассмотрена роль циркулирующих микроРНК как эпигенетических биомаркеров развития основных проявлений МетС, АИМетС, а также распределение сигнатур микроРНК в зависимости от риска развития АИМетС.
Объявления
2025-07-31
Журнал «Безопасность и риск фармакотерапии» включен в базу данных Russian Science Citation Index (RSCI)
Решение о включении журнала «Безопасность и риск фармакотерапии» в список RSCI было приято Рабочей группой в соответствии с заключениями ведущими российскими учеными на основании формальных критериев, библиометрических показателей, общественной экспертизы, добросовестности публикаций и издательской этики.
| Еще объявления... |
ISSN 2619-1164 (Online)